Actualización: Nueva combinación de medicamentos para el tratamiento de segunda línea para algunos cánceres de mama avanzados HR+
La FDA aprobó el uso de Truqap más Faslodex para el tratamiento del cáncer de mama metastásico con receptores hormonales positivos (HR+) y HER2- que reaparece o empeora tras el tratamiento con terapia hormonal. La aprobación es para tratar cánceres en personas cuyos tumores tenían una mutación en uno de tres genes. Para las personas con una de estas mutaciones, Truqap mejoró el tiempo hasta que el cáncer reapareció o empeoró. (Publicado el 2/9/24)
RELEVANCIA
Este artículo es de mayor interés para: Personas con cáncer de mama positivo para receptores hormonales (HR) o negativo para HER2 que se ha diseminado fuera del tejido mamario..
También es de interés para:
- Personas con cáncer de mama
- Hombres con cáncer de mama
- Personas con cáncer de mama HER2+
- Personas con cáncer metastásico o cáncer en etapa avanzada


Relevancia: Media-alta

Línea de tiempo: Posterior a la aprobación
¿De qué se trata esta actualización?
Ahora se puede utilizar Truqap (capivaseratib) más Faslodex (fulvestrant) para tratar a ciertas personas con cáncer de mama avanzado. Faslodex es un tipo de terapia hormonal que se administra mediante inyección. Truqap es una pastilla que se administra por vía oral y actúa impidiendo la multiplicación de las células cancerosas.
La FDA aprobó esta combinación como tratamiento de segunda línea en personas con cáncer de mama localmente avanzado o metastásico HR+ y HER2- en las siguientes situaciones:
- Personas cuyo cáncer de mama metastásico reapareció y empeoró después de recibir terapia hormonal.
- Personas cuyo cáncer de mama en etapa inicial reapareció mientras recibían el primer tratamiento o en los 12 meses siguientes a finalizarlo.
Truqap sólo está aprobado para personas con un tumor que presente una mutación en uno de tres genes: PIK3CA, ATK1 o PTEN. La prueba tumoral Foundation One CDx también fue aprobada por la FDA para la identificación de las personas con más probabilidades de beneficiarse de este nuevo tratamiento combinado.
Resultados del estudio
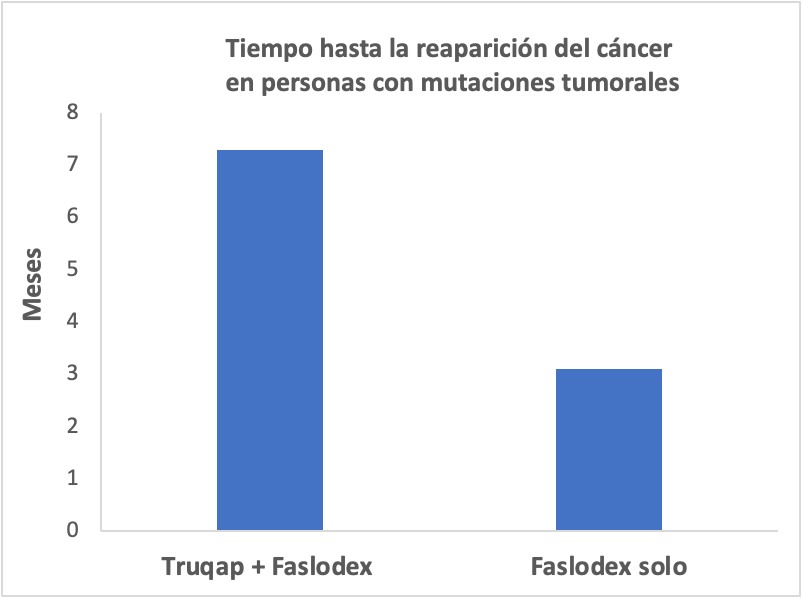
La aprobación de la FDA se basó en el estudio CAPItello-291, que comparó Truqap más Faslodex con Faslodex solo. En este estudio participaron un poco más de 700 personas con cáncer de mama localmente avanzado o metastásico HR+ y HER2-. Un grupo recibió Truqap más Faslodex, mientras que el otro grupo recibió Faslodex solo.
Los investigadores analizaron el tiempo transcurrido hasta la reaparición del cáncer en ambos grupos.
Entre los participantes:
- El cáncer no reapareció durante aproximadamente 7 meses en el grupo que recibió Truqap más Faslodex, en comparación con aproximadamente 4 meses en el grupo que recibió Faslodex solo.
Cuando los investigadores analizaron el subconjunto de participantes con una mutación tumoral en los genes PIK3CA, ATK1 o PTEN:
- El cáncer no reapareció durante un poco más de 7 meses en el grupo que recibió Truqap más Faslodex, en comparación con los 3 meses en el grupo que recibió Faslodex solo.
A los 18 meses, la supervivencia general fue mayor en el grupo que recibió Truqap más Faslodex en comparación con el grupo que recibió Faslodex solo.
Efectos secundarios del Truqap
Los efectos secundarios del Truqap fueron:
- Sarpullido
- Diarrea
- Niveles altos de azúcar en la sangre
- Hiperglucemia (necesidad de insulina y hospitalización)
Entre los pacientes que recibieron Truqap, los efectos secundarios más frecuentes fueron sarpullido y diarrea. En el 18 % de estos pacientes se presentó hiperglucemia (niveles elevados de azúcar en la sangre). La hiperglucemia de grado 3 (necesidad de insulina y hospitalización) o de grado 4 (de riesgo vital) se presentó en el 2.8 % de los pacientes.
Antes de tomar Truqap deben comprobarse los niveles normales de glucosa en sangre en ayunas y de hemoglobina A1C. Las personas que toman Truqap y tienen antecedentes médicos de diabetes deben ser controladas con mayor frecuencia.
¿Qué significa esto para mí?
Si usted tiene un cáncer de mama localmente avanzado o metastásico HR+ o HER2- que reaparece después del primer tratamiento, consulte con su médico sobre la posibilidad de analizar su tumor para ver si cumple con los requisitos para tomar Truqap más Faslodex u otro tratamiento específico.
La nueva combinación de medicamentos puede aumentar el tiempo hasta la reaparición del cáncer, sobre todo si su tumor tiene una mutación en los genes PIK3CA, ATK1 o PTEN. También puede ayudar a mantener su calidad de vida y retrasar el momento en que sea necesaria la quimioterapia.
Bibliografía
La FDA aprueba el uso de capivasertib con fulvestrant como tratamiento contra el cáncer de mama. Boletín informativo de la FDA. 16 de noviembre de 2023.
Declaración de divulgación: FORCE recibe financiamiento de patrocinadores de la industria, que incluyen a empresas que producen medicamentos, pruebas y dispositivos contra el cáncer. Todos los artículos de XRAY se redactan de manera imparcial respecto a cualquier patrocinador y se someten a revisión por parte de los miembros de nuestro Consejo asesor científico antes de su publicación con el fin de garantizar la integridad científica.
Compartan sus opiniones sobre esta revisión de XRAY respondiendo nuestra breve encuesta.
- ¿Se me han realizado pruebas para detectar tumores?
- ¿El medicamento Truqap es adecuado para mí?
- Si tengo diabetes, ¿puedo tomar Truqap?
- ¿A dónde puedo acudir a hacerme un análisis de azúcar en la sangre? ¿Con qué frecuencia debo repetir la prueba mientras tomo Truqap?
- ¿Hay algún otro medicamento que pueda tomar si no puedo tomar Truqap?
La Red nacional integral del cáncer (NCCN, por sus siglas en inglés) indica que las pruebas tumorales pueden ayudar a determinar si una persona con cáncer de mama metastásico se beneficiaría de una terapia específica.
- En el caso de los tumores con receptores hormonales positivos y HER2-, se recomienda realizarse pruebas de detección de mutaciones en los genes PIK3CA, ATK1 o PTEN para ayudar a identificar a pacientes que se beneficiarían de una terapia específica conocida como inhibidores de PI3K.
- En el caso de tumores con receptores hormonales negativos y HER2-, se recomienda realizarse pruebas de PD-L1 para ayudar a identificar a pacientes que podrían beneficiarse de la inmunoterapia.
En los tipos de tumores de mama metastásicos, las pruebas de deficiencia en la reparación de errores de emparejamiento de ADN (dMMR) e inestabilidad microsatelital alta (MSI-H) u otros biomarcadores pueden ayudar a identificar a pacientes que se beneficiarían de la inmunoterapia.
actualizado: 01/29/2024